来源:清新电源 研究背景 电催化CO2还原反应 (CO2RR) 为可再生电力能源以储存在化学键中的形式转化为高附加值的燃料和化工原料提供了一种可行的方法。在CO2RR的不同产物中,CO2转化为CO因其技术和经济上的可行性被认为是化学工业中最有前途的反应之一。将催化剂和电解质设计以及催化机理相结合,提供科学的见解,以推动这项技术走向工业应用的征程。CO2RR不同产物的热力学氧化还原势接近,导致了其对特定产物的选择性较差。因此,促进CO2RR成为存储可再生能源的可行选择,必须克服有关高能耗和低选择性的障碍。其中,电还原CO2至CO已经具备高的电流密度和法拉第效率,选择性地将CO2还原为CO非常有希望实现工业应用,这为建立可持续的碳中和提供了解决方案。在此过程中,可再生能源驱动CO2电解槽,将CO2转化为CO, 然后CO可作为化学原料,进而生产多种燃料。由此产生的燃料可以被储存、分配或消耗,释放出CO2作为主要产物,然后被捕获并回收回反应堆,关闭碳循环。 成果简介 在这篇综述中,南开大学陈军院士和严振华博士(共同通讯作者)等人综述了近年来CO2选择性转化为CO的研究进展和面临的挑战,从原子水平解读催化材料,并对电解质和器件的设计进行了全面分析总结,以提高电催化CO2还原为CO的选择性和活性。最后,确定了CO2RR目前存在的瓶颈,提出了CO2RR在CO产业化应用中尚存在的技术挑战和未来的发展方向。该工作以“Advances and Challenges for Electrochemical Reduction of CO2 to CO: From Fundamental to Industrialization”为题,发表在 Angew. Chem. Int. Ed. 期刊上。 图文导读 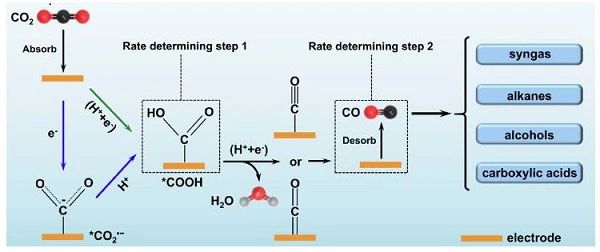
图1 电催化CO2还原为CO的可能反应途径 如图1所示,作为一个涉及双电子、双质子的反应过程,CO2分子首先在催化剂表面吸附,然后通过协同质子-电子转移 (CPET) 过程还原为*COOH中间体,然后另一个H+和e-攻击*COOH,形成H2O和 *CO。最后 *CO从电极表面脱附,得到 CO气体产物。结果表明,*COOH易于转化为*CO,但由于催化剂与*COOH结合较弱,抑制了CO2转化为*COOH。*CO的与催化剂的结合较强也阻碍了CO在电极表面的脱附。这两个步骤被认为是CO2 还原成CO的速率限制步骤。另一种可能生成 *COOH的途径对CO2的初始活化略有不同。CO2活化的第一步不涉及CPET过程,而是一个解耦的电子和质子转移过程,从电极表面CO2•−自由基阴离子的形成开始。使用合适的电催化剂可稳定CO2•−,通过在CO2和催化剂之间形成化学键,从而降低活化过电位。CO2RR的活性和选择性本质上取决于反应路径上各反应步骤中的中间体结合能。不同中间体的结合能通过热力学标度关系成比例关联。因此,无法在不影响另一种中间体的情况下优化某一中间体的结合能。此外,析氢反应 (HER) 是水溶液中主要的竞争反应,催化剂上的H结合能需要考虑。因此,为提高CO2RR的活性和CO产物的选择性,应采取打破标度关系以及抑制HER的策略。 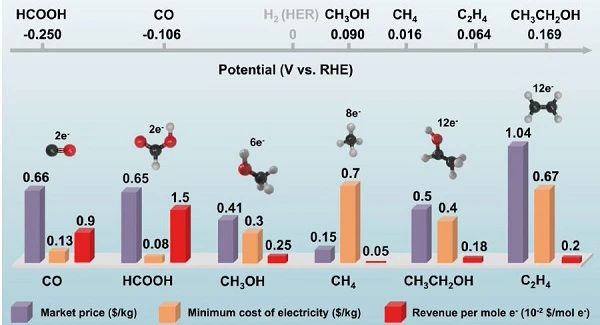
图2 CO2电解产物的标准还原电位(上图);根据产品的市场价格、每千克最低电力成本和每摩尔电子消耗产生的收入对产品进行经济分析 (下图)。 法拉第效率(FE)表示特定CO2还原产物的选择性。选择性差不仅导致CO2电解槽利用率降低,而且增加了产品分离成本。目前,只有CO和HCOOH的产率高,FE接近100%,而乙烯的最大选择性为80%,乙醇的最大选择性为52%,正丙醇的最大选择性为30%。长链烃类需要多个CO2分子在催化剂表面吸附并协同转化,导致选择性急剧下降。CO2转化为CO是一个两电子转移过程 (E0co = −0.11 V vs. RHE),考虑到工业用电价格为 $0.05/kWh, CO2转化为CO的最低成本为 $0.13/kg (图2)。相反,C2 - C4产品每千克的电力成本要高得多,因为它们涉及CO2RR过程中更多的电子转移。此外,电催化还原CO2生成C2+产物的反应途径包括多个单步反应,进一步加剧了动力学的迟缓,导致较高的过电位。因此,以CO2RR产品的市场价格与电力成本作为基准,CO和HCOOH是最有前途的实现工业化应用的目标产品。但是,考虑到分离成本,通常需要从液态电解质中分离甲酸酯液体产品,根据Sherwood图,其分离成本达到 $60 t−1,而分离CO气体的成本约为 $10 t−1。此外,CO作为合成气 (一种工业气体原料,以H2和CO为化学合成的主要成分) 的组分,可经过费托化学的下游加工制备一系列有机化工产品。传统的CO是通过反水气相移反应产生的,这是一种需要在高温(>400 oC)下进行的吸热反应。该工艺受到能耗大,反应速率慢,成本高等的限制。因此,电催化CO2转化为CO是实现CO2电化学工业化在经济和技术上最可行的途径。 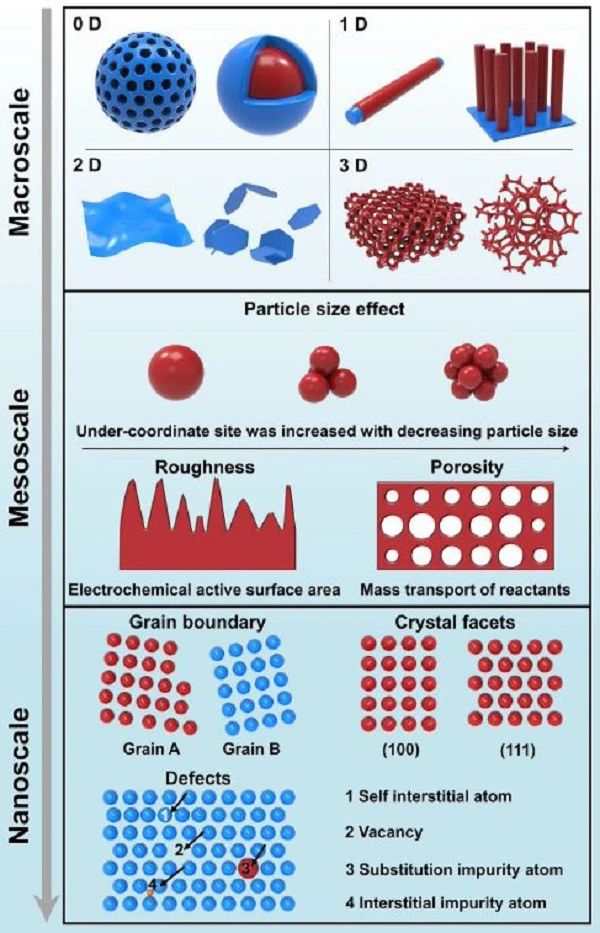
图3 CO2RR电催化剂材料中不同维度和尺度的影响 在电化学CO2循环系统中,CO2RR的性能主要依赖于催化材料,因此需要在不同的尺度上理解催化剂的作用。如图3所示,在纳米尺度下,活性中心配位数和催化剂局部电子结构可以通过晶面、晶界和缺陷来调控以进一步改善催化剂的活性和选择性。电极材料的介观结构 (粒径和孔隙率) 对反应物的传质和电化学活性表面积有很大的影响。可通过控制材料的宏观形貌使催化剂活性位点最大化。研究者对催化剂进行系统的总结,包括金属基电催化剂、单原子催化剂、无金属碳基催化剂和分子催化剂。研究者详细讨论了各自的特征、设计策略及其对CO2RR性能的影响。 各种不同阴离子组成 (金属、合金、氧化物、硫化物、硒化物等) 的金属基电催化剂具有较高的导电性,可以快速地将电子转移到表面活性位,从而提高催化剂基器件的功率和能量密度,并提高其固有活性。制备条件和方法对金属基电催化剂的活性有很大的影响。表面工程、形貌控制和成分控制可以极大地调节催化活性、稳定性和选择性。因此,金属基电催化剂是CO2RR领域中研究和应用最广泛的。根据材料的维度不同可将金属基催化材料分为0D、1D、2D、3D金属基材料。0D材料中的电子在三个方向上都受到限制,这可能对纳米极限下的电子态密度施加量子限制。因此,0D材料的电子结构与体积材料有本质的不同,具有低配位位点和大的比表面积-体积比。1D材料具有丰富的边位、定向电子/物质传输和对应力变化的耐受性,已成为一类潜在的CO2RR催化剂。2D材料的构建越来越受到人们的关注,因为(1) 高的表体积比,可以最大限度地提高原子利用率; (2) 大量低配位原子作为催化活性位点; (3) 原子层厚度可以减小载流子迁移距离,促进电子传递。2D纳米片的表面有大量暴露的表面原子,这些原子很容易从晶格中逃逸形成空位缺陷。2D纳米片在合成过程中通常伴随着无序结构的形成,这种缺陷会降低表面原子的配位数,进而促进反应物的化学吸附,提高催化性能。厚度调控、元素掺杂和异质结构等原子级工程已被广泛应用于提高2D材料的催化活性。质量传输的限制通常会导致局部不活跃位点的形成,并伴随CO2转换效率的降低。优化电极的3D结构可以促进反应物的快速扩散,并保持大量的催化活性位点。 金属催化剂中存在的不理想的活性位点,会降低催化剂的CO2RR活性或选择性。单原子催化剂 (SACs) 将均相催化剂和多相催化剂的优点结合在一起,分散在固体基底上,可以解决上述问题。近乎最大化的原子利用率,不饱和的配位环境不仅降低了过量金属造成的高成本,而且提高了催化剂的性能。对于SACs中金属原子的d带,d态价电子接近费米能级,可提供快速的电子转移和促进CO2中间体吸附,有助于克服CO2RR的高活化势和动力学缓慢的问题。由于单原子中心的简单性,它们通常只能催化单分子的基元反应。因此,SACs不能催化C-C偶联,但能有效促进CO2转化为CO。特别是金属原子与配位之间的较高的结合强度可以在应用过程中获得优异的稳定性。由于这些特性,SACs被认为是一种很有前途的高效CO2RR电催化剂。与本体金属不同,SACs的价态与其配位环境密切相关。因此,我们可以通过在不同的配位环境中组成金属原子来调控金属原子的电荷密度和电子结构。从SACs中了解CO选择性的原子尺度机理,可为催化剂的合理设计提供预测指导。 无金属碳基材料具有丰富的自然资源、高温稳定性、高比表面积、优良的导电性、环境友好性和对酸碱的化学惰性等独特的优点。原始无缺陷碳材料对CO2RR的固有活性贡献很小,因为中性碳原子没有能力激活CO2分子。利用缺陷或空穴,在碳晶格中加入杂原子,可以调节相邻碳的电荷密度和电子结构,有利于优化碳材料的载流子浓度,提供丰富的活性位点。另一方面,碳作为最通用的元素,其同素异形体的形式多样性在于其杂化的多样性,即sp1、sp2和sp3。它们可以被包裹成0D富勒烯,卷成1D纳米管,或者堆叠成3D石墨。它们的物理和化学性质可以通过调整孔隙大小和碳的曲率来调控。得益于这些优势,无金属碳基催化剂表现出显著的CO2RR特性,包括杰出的催化活性、持久性和高选择性。2013年,Kumar等首次报道了无金属碳基材料作为CO2RR的高效催化剂。CO2RR能力归因于带正电荷的碳原子,而不是带负电荷的N原子。他们研究了不同N物种 (石墨N、吡啶N和吡咯N) 对CO2RR的作用。实验结果表明,石墨N和吡啶N显著降低了过电位,提高了CO2转化为CO的选择性。DFT计算显示,吡啶N保留的孤对电子能够结合CO2。对于石墨N,电子位于 π* 反键轨道,导致CO2不易结合。通过控制N掺杂剂的种类和含量,碳基催化剂产CO的FE可达到90%,并在60小时内保持稳定。除了N掺杂外,掺杂S、F或Si的碳纳米材料或共掺杂N碳纳米材料也可以调节电子结构和表面特性,从而进一步提高CO2RR活性。 与多相催化剂相比,分子催化剂具有明确的活性位点结构,可明确结构-机理-活性关系。通过有机合成具有指定功能片段的分子催化剂不仅易于修饰,而且提供了在催化位点附近控制空间和调控电子结构的优势,这有助于合理设计新的催化剂结构以提高性能。因此,这些体系通常表现出高选择性,生成CO的FE > 95%。金属酶是一类特殊的分子催化剂,自然界中的酶通常将驱动氧化还原所需的能量最小化,因为生物必须充分利用可用的资源以减少能量损失。因此,它们可以以极快的速度进行多电子和质子传输,且过电位较低。来自厌氧菌的CO脱氢酶包含一个Ni4FeS4簇,在将CO2还原为CO时显示出很低的过电位。卟啉和酞菁类有机金属配合物作为CO2RR最常见的均相催化剂,得到了广泛的研究。改变金属中心周围的配位数、氢键和路易斯酸相互作用等二次配位成为下一代催化剂设计的重点。近年来,MOFs和共价有机框架 (COFs) 因其高比表面积、可调节的孔隙率、限制效应、金属的周期性排列以及种类和官能团的多样性而成为电催化领域的一个新领域。与传统的固体金属电极相比,有序多孔的网络可以让离子和溶解的CO渗透到薄膜内部。同时,固有的孔隙约束特性可导致局部CO2浓度的提高,这可能使CO2RR可以在稀释的CO2环境中催化。大多数分子催化剂以配体框架支撑的金属中心为特征,然而,鉴于大规模工业应用,迫切需要在可接受的能源产量下合成燃料的无金属催化剂。因此,可再生且易回收的无金属聚合物可直接用作CO2RR电催化剂。 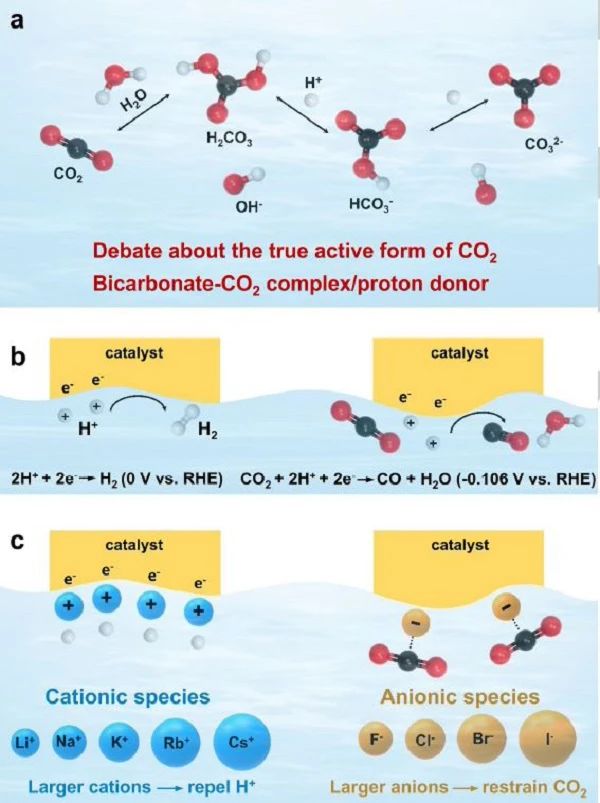
图4 (a) 水溶液中的CO2/H2CO3、H2CO3/HCO3- 和HCO3-/CO32- 平衡对pH、电解质组成和缓冲容量敏感,导致CO2RR过程中CO2的真实活性形式存在争议;(b) 根据吉布斯自由能: 其中t为氧化还原反应中转移的电子数,h为法拉第常数,HER在热力学上比CO的生成更有利;(c) CO2RR领域的阳离子和阴离子效应。 电解质作为质子或中间物质转移的介质,其浓度、缓冲容量、pH值、电导率、阳离子和阴离子类型对催化剂的活性和选择性有很大的影响。然而,电化学CO2RR系统的复杂性使得单个参数与电催化剂性能之间无法直接关联。深入了解可以帮助预测电催化性能,以及开发可扩展的工业应用电解槽。研究者概述了电解质 (包括水溶液、有机电解质和离子液体) 在CO2RR中的应用及其对CO2RR选择性和活性的影响。 当CO2溶于水溶液时,不同的碳质物质如CO2、H2CO3、HCO3−和CO32−会形成,这导致了CO2RR过程中CO2真正的活性形式的争论 (图4a)。在类似的pH值和电位下,碳酸氢盐电解质的CO2RR活性高于其他水溶液,这可能与碳酸氢盐-CO2络合物的形成有关。这种复合物是CO形成过程中碳的主要来源。通过原位光谱、同位素标记和质谱研究的结合Marco Dunwell等人得出了结论: 碳酸氢盐通过水溶液中CO2 和HCO3- 之间的快速平衡交换,提高了电极附近溶解CO2的有效浓度,从而提高了CO2到CO的转化。电解质中CO2 (aq) 的主要成分来源于与碳酸氢盐的平衡,而不是CO2 (g) 的扩散,这表明碳酸氢盐不仅仅是pH缓冲液或质子供体。因此,从碳质活性反应物比例高的角度出发,提出以KHCO3溶液作为合适的电解质。 电解液的pH值对催化性能至关重要,这与CO2 对CO32−的CO2/碳酸盐/碳酸氢盐缓冲平衡以及竞争的HER有关。如式所示: CO2(aq) + H2O ⇆ H2CO3 ⇆ H+ + HCO3− ⇆ 2H+ + CO32−,随着pH值的增加,CO2/碳酸盐/碳酸氢盐缓冲平衡向碳酸氢盐和碳酸盐的形成方向转移。Zhong等研究了不同电解质在CO2 饱和过程中pH值的变化。0.1 M KHCO3的pH值由9下降到6.97;在0.1 M KOH电解液中,pH值由13.0下降到7.2。随着CO2/碳酸盐/碳酸氢盐平衡pH值的增加,主要溶解碳质组分发生H2CO3 → HCO3- → CO32- 的变化。在水介质中,由于在CO2RR和HER过程中H+被消耗 (图4b),根据Nernst方程,质子活性直接影响反应的平衡势。因此,酸性条件不仅有利于CO2的质子化,而且有利于低pH值下的HER竞争。Gao等人研究了pH值对Pd NPs电催化将CO2 还原为CO的影响。他们发现,当pH为2.2时,Pd NPs上的CO偏电流密度达到最大值,而当pH为1.5到4.2时,CO生成的FE从3.2% 增加到93.2%。Pd NPs对CO2RR的pH依赖性归因于催化剂表面氢键键能的增加。由于CO2还原反应发生在电极表面,因此电极附近的局部pH值直接影响反应路径和动力学,因为该反应需要CO2和H+共同参与CO2RR过程。局部pH值取决于电解液的缓冲强度、CO2饱和度、反应物和产物的扩散系数、电极结构和反应器搅拌等操作条件。当法拉第电流产生时,局部pH值和局部碳质物质浓度会发生变化。由于HER和CO2RR均生成氢氧化物,电极附近的界面pH值总是高于体溶液。 目前,对水溶液的研究大多集中在含有阳离子、缓冲阴离子、非缓冲阴离子的弱酸性或碱性电解质上。阳离子效应在CO2RR领域受到广泛关注,特别是碱金属的效应。大的阳离子容易吸附在电极表面,产生较低的外亥姆霍兹平面电位,从而改变电极表面的H覆盖,排斥电极上的H+离子(图4c)。对于小阳离子,如Li+,强烈水合防止吸附阳离子在电极表面。这解释了实验中观察到的当水溶液中存在较大阳离子时HER活性降低的现象。Angel Cuesta el等发现pH值的增加幅度遵循Li+ > Na+ > K+ > Cs+ 的趋势,最活跃的电解质也是界面pH增加最小的阳离子。除阳离子外,阴离子对CO2RR的结果也有显著影响。非缓冲阴离子一般处理卤化物效应,这取决于卤化物的大小和浓度。Strasser和他的同事最近的一项研究表明,与无卤化物电解质相比,Cl- 和Br- 的添加可以增加CO的选择性。作者认为,卤化物吸附影响电极界面的表面电荷,使CO2受到更强烈的抑制,从而提高还原电流。此外,吸附的卤化物抑制质子吸附,并诱导高的氢吸附过电位。Hwang等人也研究了卤化物离子对CO2选择性还原成CO的影响。卤化物阴离子的尺寸和亲核性减小的趋势为I−> Br−> Cl−> F−。 由于F- 离子的尺寸小,易被水分子溶剂化以及强氢键攻击,削弱了它们在电极表面的吸附。因此,F- 基电解质的pH值高于Cl-、Br- 和I-。结果表明,F− 对CO选择性较低的Zn电极具有负效应。因此,在较高的质子浓度下,HER抑制效果预期不如以往的研究。作者推测,F- 可能导致电极表面更粗糙,更致密以及更少的ZnO物种。这反过来导致了较慢的CO解吸率和较低的高效HER抑制。除阴离子或阳离子对CO2RR的影响外,还应考虑电解液的电导率和成本,基于Cs+ 和Rb+的电解质可能过于昂贵,不利于大规模实施。电解液的电导率低 (如0.1 M KHCO3的电导率为10 mS cm-1,而1.0 M KOH的电导率为220 mS cm-1) 会产生较大的欧姆损失,从而导致在运行流槽电解槽时,严重影响其能量效率。 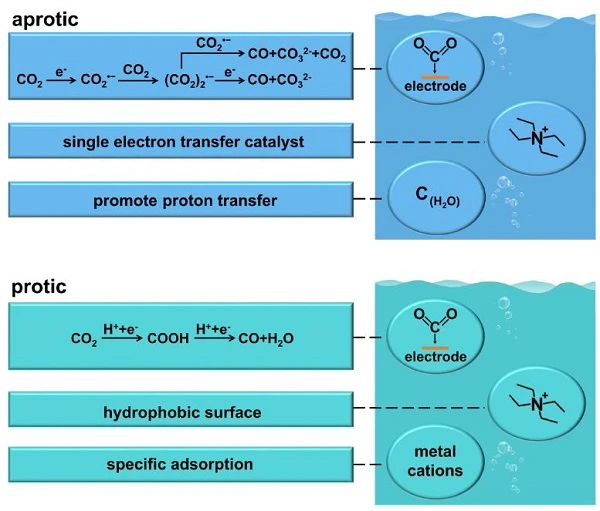
图5 质子和非质子有机电解质中CO2电催化还原为CO的反应途径。 CO2在水中的低溶解度 (0.033 M at 25°C, 1 atm),对CO2RR的质量传输产生不利影响。有机电解质可增加CO2的溶解度,从而提供了高CO2还原电流的优势。此外,由于有机溶剂对氧化还原反应的敏感性一般低于水溶液,因此可以提高适用的电位范围。考虑到分子催化剂,它们容易在水电解质中水解,而水电解质一般需要添加有机溶剂。有机电解质可分为质子溶剂和非质子溶剂。即使是对于相同的电催化剂,在质子溶剂和非质子溶剂中,CO2电催化还原成CO的反应路径也是不同的 (图5)。在非质子溶剂中,与质子化中间体相比,CO2RR需要形成一个CO2•−阴离子自由基,具有较大的过电位。另一方面,在非质子溶剂的帮助下,可以避免竞争的HER。在质子溶剂中,提议的反应机制包括在碳氢化合物的形成过程中,从溶剂到中间体的质子转移或在CO的形成过程中,从中间体到溶剂的氧转移。在质子溶剂中,提出的反应机制包括烃类生成过程中溶剂向中间体转移质子;或CO生成过程中,中间体向溶剂转移氧气。然而,非质子溶剂的介电常数会影响电化学CO2 - CO转化所需的过电位。高介电常数可提高溶液的电导率,THF的相对介电常数为7.58,而DMF的相对介电常数为36.7,乙腈的相对介电常数为37.5。此外,由于碱金属卤化物的溶解度低,不能提供足够的电导率,不同的盐被应用在非质子溶剂中。高氯酸盐、四氟硼酸盐、六氟磷酸盐、磺酸盐和四烷基铵盐由于其非极性性质,通常被添加到非质子溶剂中,在非质子溶剂中具有高溶解度。与质子溶剂相比,非质子溶剂通常需要较高的过电位,因此这些盐在较宽的电位窗口内是稳定的。虽然有机电解质与水溶液相比对CO2RR有积极的影响,但价格、毒性、安全隐患和低电导率限制了其应用。目前对水添加剂的研究表明,有机电解质经大量水稀释后仍能保持其功能性。因此,有机电解质作为CO2RR体系中的添加剂将成为研究热点。 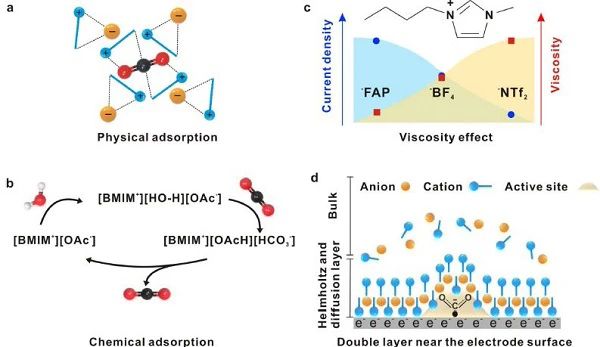
图6 (a) CO2在非碱性亲核阴离子的离子液体中的物理吸附;(b) CO2的化学吸附主要是在具有易脱质子的酸性离子液体和碱性阴离子的离子液体中进行的;(c)离子液体粘度和电流密度的影响;(d)电极表面附近的双层结构。 离子液体 (ILs) 通常被认为是一种各向异性的流体,表现出一种扩展的类超分子网络特性。这表明它们的介观和纳米结构可能导致与水溶液不同的反应机理。ILs的作用主要可描述为吸附CO2和稳定CO2•−,这与阴离子和其性质所施加的电子性质有关。CO2在离子液体中的溶解有两种形式: 物理吸附 (图6a) 和化学吸附 (图6b)。物理吸附主要发生在离子液体中,与非碱性亲核阴离子如双(三氟甲基)磺酰酰胺等发生吸附,CO2可局限在离子液体中烷基和芳香质子附近的空腔内。这种弱相互作用不会破坏离子液体中的阳离子-阴离子氢键,使离子液体结构发生细微变化。CO2的化学吸收主要是通过羧化作用发生的,CO2在羧化过程中转化为碳酸氢盐。在含酸性质子和碱性阴离子 (如醋酸盐和咪唑) 的富质子介质中观察到这种CO2吸附。生成CO2•−的高热力学势垒是离子液体中的速率决定步骤,它导致高过电势以达到较快的反应速率。大多数离子液体是粘性的,因此它会影响带电离子的运动,从而限制了溶液中的传质和溶液的电导率。因此,离子液体通常溶解在水溶液中,稀释离子液体可以优化电解质的pH和粘度等体积参数。pH的下降是由于羟基离子的形成,如[BF3OH]−,[BF2(OH)2]−,或 [BF(OH)3]−,导致质子利用率的增强,从而提高了CO2的还原速率。在50 mol% 的水和50 mol% 的EMIM-BF4电解液中,电流密度比纯EMIM-BF4高近5倍。尽管CO2RR中的离子液体有很多优点,但也存在一些缺点。大多数离子液体价格昂贵,而且具有环境毒性。阴离子如四氟硼酸盐可以分解为HF,而阳离子如长烷基链咪唑啉则具有更强的毒性。 
图7 (a) 气体扩散电极示意图;(b) 液相和 (c )气相电解槽原理图和横断面图。 大部分的CO2RR研究都集中在催化剂的优化上,在H型电池中进行性能测试。在H型电池中,水中可溶的CO2 只有34 × 10−3 M,限制了电流密度 < 100 mA cm−2。此外,这些系统的稳定性一般在几十小时左右。对于工业应用,电流密度应高于300 mA cm−2, FE高于80%,电池电压小于1.8 V,稳定性超过80000小时,才能使产CO在经济上可行。受水电解槽的启发,CO2 技术也采用了类似的电解槽架构,以满足商业需求 (图7)。历史上,各种电解槽配置主要是从膜电极组装的kenis型结构,将催化剂、气体扩散电极 (GDE)和离子交换膜组合成一个单元。在电解槽系统中,CO2从气相供应到GDE, GDE形成气-液-固界面;催化剂沉积在GDE上,这使得CO2、催化剂和电解质之间可直接接触。使用GDE可将CO2 向催化剂表面的扩散路径从H池内的 ~50 μm减小到 ~50 nm以上(三个数量级)。这使得CO2能够快速转移到催化剂表面,通过绕过电解液中缓慢的CO2吸收,从而产生更高的电流密度,并最大限度地减少了传质限制。GDE作为电解槽的核心部分,由GDE和催化剂层组成 (图7)。催化剂可以通过喷绘、滴铸、电沉积或直接压缩到多孔层再负载在GDE上。GDE是一种具有疏水性能的多孔导电结构,由大孔衬底和微孔层组成。常见的流动槽是液相电解槽,它由三个通道组成,分别为CO2气体、阴极液和阳极液。催化剂位于GDE上,与电解液接触,气相CO2通过GDE的背面不断地输送到催化剂上。同时,阳极液和阴极液通过离子交换膜分离。离子交换膜可防止CO2RR产物和O2 的接触,它们可以分别被氧化/还原为CO2和H2O。与液相电解相比,气相电解具有较低的欧姆损耗,且由于电解泵和流场较少,容易加压。此外,电解液的消除减少了电解液杂质沉积在催化剂上和碳酸氢盐/碳酸盐上的可能性。然而,如果产生液体产物,它们将在GDE中积累,阻碍气体通过电极的扩散。气相电解槽由离子交换膜隔开的阴极和阳极组成。三种不同的离子交换膜:阳离子交换膜 (CEM)、阴离子交换膜 (AEM) 和双极膜 (BPM) 在气相电解槽中得到了广泛的应用。在CEM气相电解槽中,H+或其他阳离子可以从阳极移到阴极,从而更容易获得碳氢化合物。 水相CO2RR的一个关键挑战是CO2/碳酸盐/碳酸氢盐平衡,这限制了CO2RR的操作pH范围。聚合物电解质因此被提出,因为它们可以在不同的pH体系中工作,并且可能由于其厚度和背景电荷而呈现不同的离子浓度。此外,聚合物电解质的透气性低于浸渍液体电解质的多孔膜。因此,电极之间的间隙可以被最小化,从而产生一个大的电流密度与小的欧姆损失。 小 结 电化学将CO2还原为CO对于实现碳循环,缓解能源和环境问题具有重要意义。尽管仍然存在相当大的挑战,但相信通过加深对反应机理的理解,对催化剂和电解质性质的新见解,并结合最先进的电解技术改进,将在不久的将来实现用于CO供应的CO2电解。 文献信息 Advances and Challenges for Electrochemical Reduction of CO2 to CO: From Fundamental to Industrialization. (Angew. Chem. Int. Ed., 2021, DOI: 10.1002/anie.202101818) 文献链接: https://doi.org/10.1002/anie.202101818 |
 先进能源材料化学教育部重点实验室(南开大学)
Key Laboratory of Advanced Energy Materials Chemistry, Ministry of Education (Nankai University)
先进能源材料化学教育部重点实验室(南开大学)
Key Laboratory of Advanced Energy Materials Chemistry, Ministry of Education (Nankai University)
