南开大学程方益教授等人讨论了设计防冻水系锌基电池电解液所需的关键参数。从与不同锌盐及其溶解和溶剂化行为相关的基础知识开始,重点介绍阴离子和添加剂对盐溶解度、离子扩散和冰点的影响。然后,将重点放在阳离子-阴离子-溶剂相互作用的复杂结构和能量学上。此外,还评估了在低温下提高电解质性能的流行策略,讨论了锌负极的电镀和剥离动力学以及各种正极材料中的电荷存储。最后,作者考虑了目前锌电池抗冻水系电解质配方的挑战和展望了未来的研究方向。
相关工作以《Dissolution, solvation and diffusion in low-temperature zinc electrolyte design》为题在《Nature Reviews Chemistry》上发表论文。

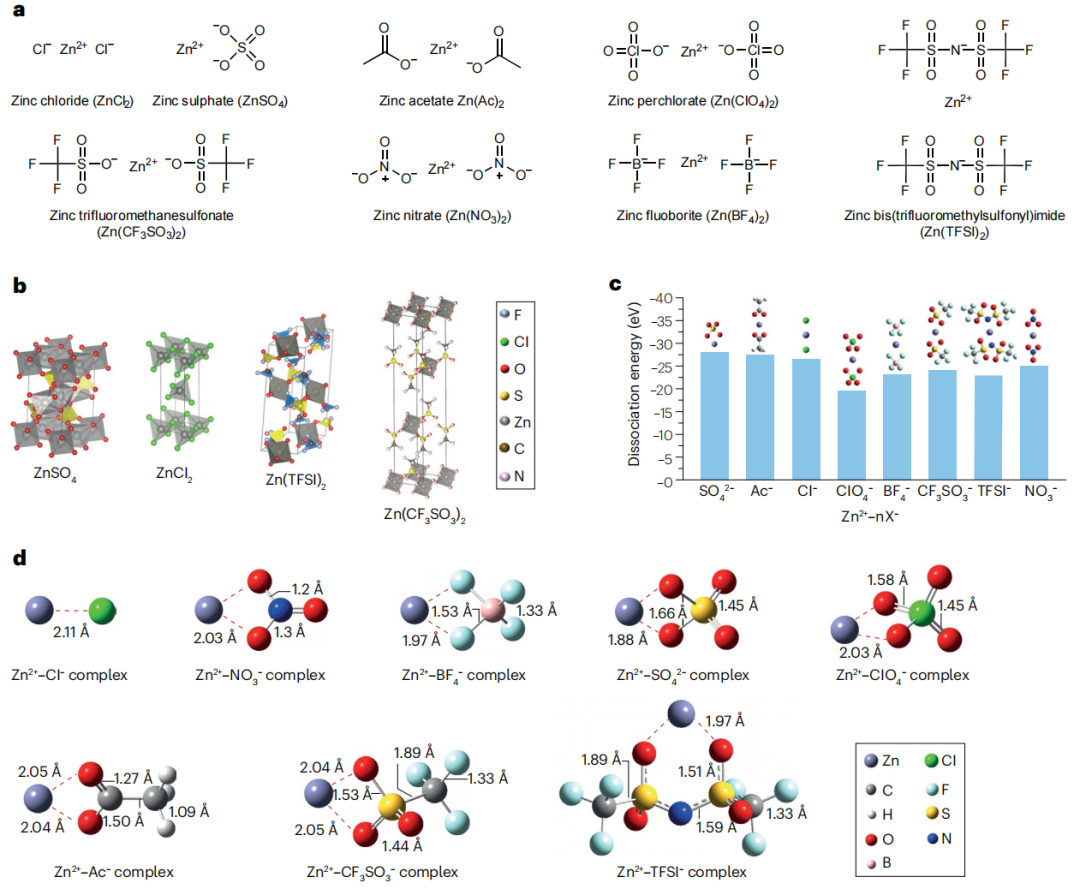
图1 常规锌盐的结构与解离
锌盐是由锌阳离子和无机或有机阴离子组成的化合物(图1a)。体积较大的阴离子,如CF3SO3-、BF4-、ClO4-和TFSI-,其负电荷分布在整个阴离子上,与Zn2+阳离子结合较弱。可以通过改变阴离子中吸电子的原子或基团来调节电负性。因此,Zn2+与离域阴离子之间的静电相互作用可以减弱,导致锌盐的晶格能降低,溶解度提高。然而,较大的电荷密度和较小的离子半径对Zn2+的水化作用明显,降低了其熵,阻碍了溶解过程。因此,常用的锌盐的溶解度低于具有相同阴离子的碱金属盐。大多数锌盐具有六配位结构,其中每个锌离子处于由六个阴离子包围的八面体几何结构中(图1b)。这种结构导致了高度对称和稳定的晶格结构,对锌盐的电化学性能有很大的影响。该规则的一个例外是ZnCl2,它采用配位数为4的四面体几何结构。晶体结构和配位几何的变化不仅影响锌盐的溶解度和熔点等物理性质,而且影响其晶格能。大多数锌盐是离子晶体,由于晶格能高而稳定;它们在水中的溶解度较低,因为要打破它们的化学键需要比共价化合物更大的能量。这些因素反过来又对锌基电池的性能产生了深远的影响,强调了理解和调整锌盐晶体学特性的重要性。锌盐具有高熔点和热分解温度,可以溶解在溶液中而不进行蒸发和分解。锌盐在溶剂中的解离倾向与成对阴离子的大小和电荷(数目和密度)密切相关。根据库仑相互作用,电荷越低,体积越大,解离越容易。理论计算证实,解离能越低,Zn2+-阴离子键长度越长(图1c、d)。如果阴离子中所有键的长度都相似,则组成阴离子的原子数量决定了分子的体积。基于行进四面体方法的计算表明,存在大量的多原子阴离子。表1总结了代表性锌盐及其电解质的溶解度、离子电导率和冰点。
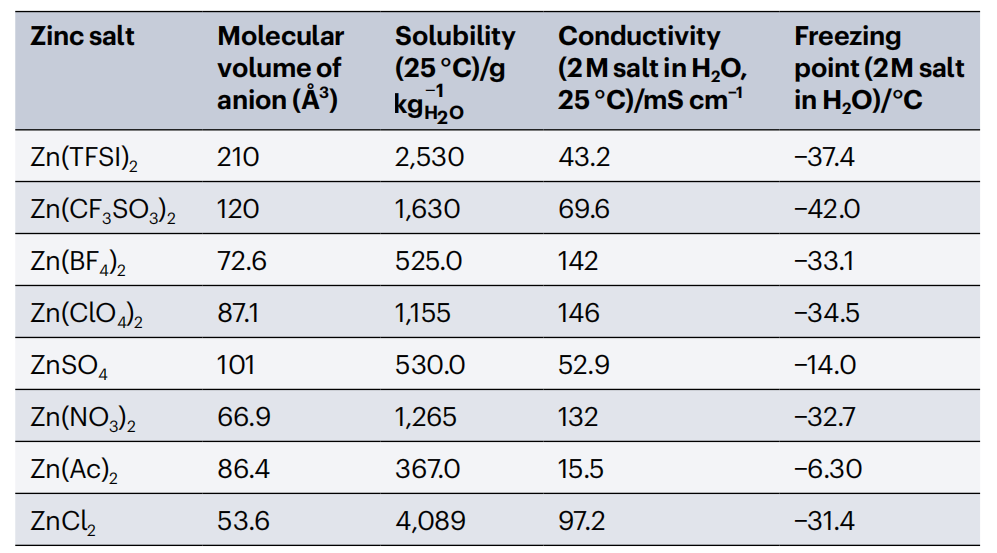
表1 代表性锌盐及其水溶液的基本性质
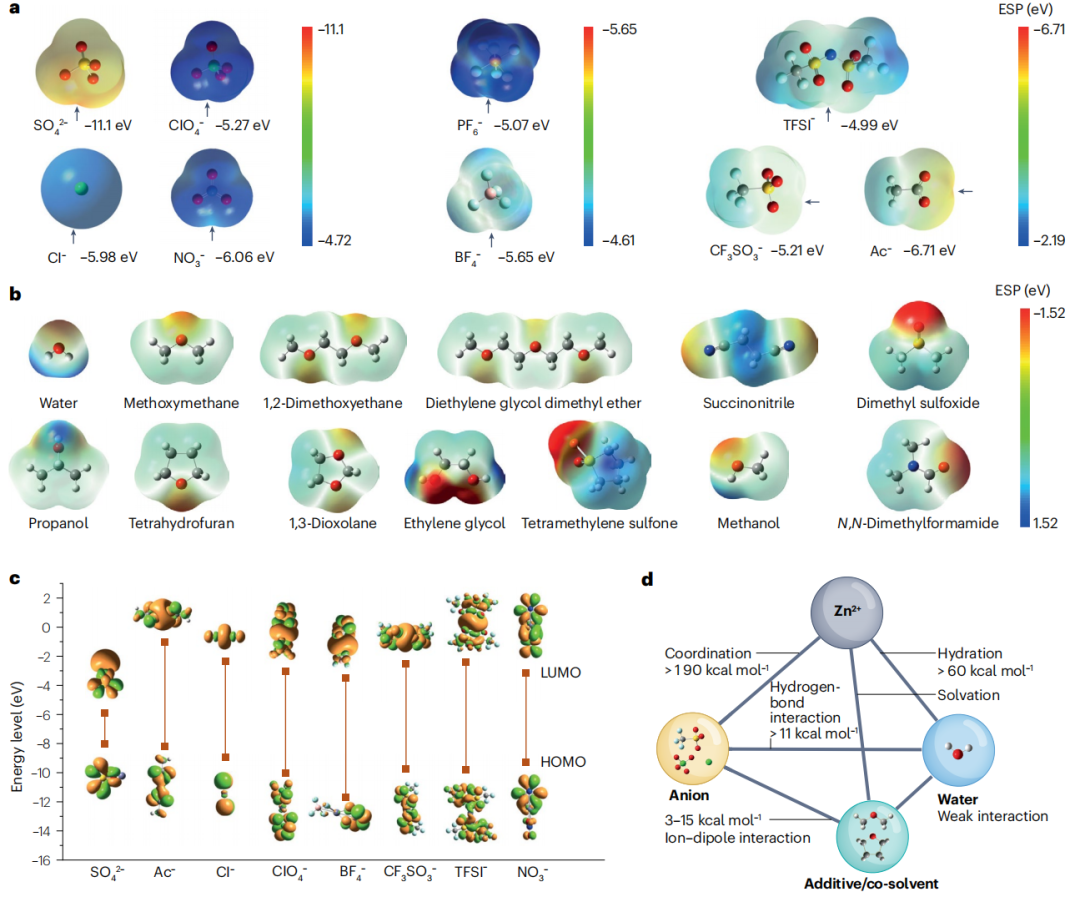
图2 Zn2+溶剂化行为的热力学描述符和相互作用
锌盐溶剂化涉及锌盐阳离子、阴离子和溶剂分子之间形成配合物。图2a描绘了九种常见锌盐阴离子的ESP图。负电荷聚集区域容易与锌离子结合,相互作用强度与负电荷聚集程度直接相关。特别值得注意的是,与其他阴离子相比,Ac-和CF3SO3-表现出不均匀的电荷分布,这意味着与阳离子和溶剂的定向相互作用。特别是,这些阴离子最负的ESP值表明它们表面上最可能与Zn2+离子相互作用的区域。ESP值还揭示了阴离子与Zn2+和水分子的结合能力,其顺序为:SO42->Ac->NO3->Cl->BF4->ClO4->CF3SO3->TFSI-。值得注意的是,SO42-具有最大的负ESP值,表明其与阳离子结合的亲和力很强。其表面的多个负电荷区促进了Zn2+-SO42-簇的良好组装,从而减少了Zn2+与H2O之间的相互作用。
由于有机共溶剂的官能团不同,其电离能表现出很大的差异。具有较高介电常数的溶剂,如乙酸乙酯和碳酸三氟丙烯,已被证明在锂离子电解质中有效,并且更容易稳定电荷和减弱静电吸引力,从而增强锌离子的溶剂化(图2b)。除ESP值外,Gutmann供体数(即表现出强氢键供体能力的分子)和有机溶剂的介电常数对锌盐的溶剂化动力学有着深远的影响。具有高给体数的溶剂,如二甲基亚砜,具有富电子官能团,能够提供电子对与Zn2+阳离子配位,促进锌盐在电解质中的溶剂化。此外,介电常数是调节盐-溶剂相互作用和Zn2+溶剂化的另一个影响参数,它受温度和电解质组成的影响。
最高已占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)的概念通常用于定性评估锌盐的电化学稳定性(图2c)。在阴离子中,BF4-具有最低的HOMO能量,表明具有较好的内在氧化稳定性,而Ac-具有最高的LUMO能量,表明具有显著的还原抗性。尽管计算精度有限,但研究分子轨道为从热力学角度预测锌盐和溶剂的电化学稳定性提供了有价值的见解。Zn2+溶剂化组分的改变会引起HOMO-LUMO特性的改变,从而影响成键阴离子和溶剂分子的氧化或还原稳定性。
从Zn2+的微观溶剂化结构出发,可以预测RZBs在低温快速充放电时的性能。通过选择合适的组分,优化溶剂化结构,可以有效地促进Zn2+离子的迁移。为了评价水溶液中各组分的相互作用,需要量化5种成对相互作用,包括Zn2+-阴离子、Zn2+-水、阴离子-水、阴离子-添加剂或助溶剂以及水-水相互作用(图2d)。通常,Zn2+与阴离子之间的配位能占主导地位,其次是Zn2+(H2O)x的水合能(1<x<6)。阴离子与电解质添加剂或共溶剂的离子偶极相互作用较弱。此外,阴离子与水之间的带电氢相互作用略高于水中的氢键。大范围的相互作用能量表明,通过调整电解质成分来改善RZBs的性能有很大的空间。
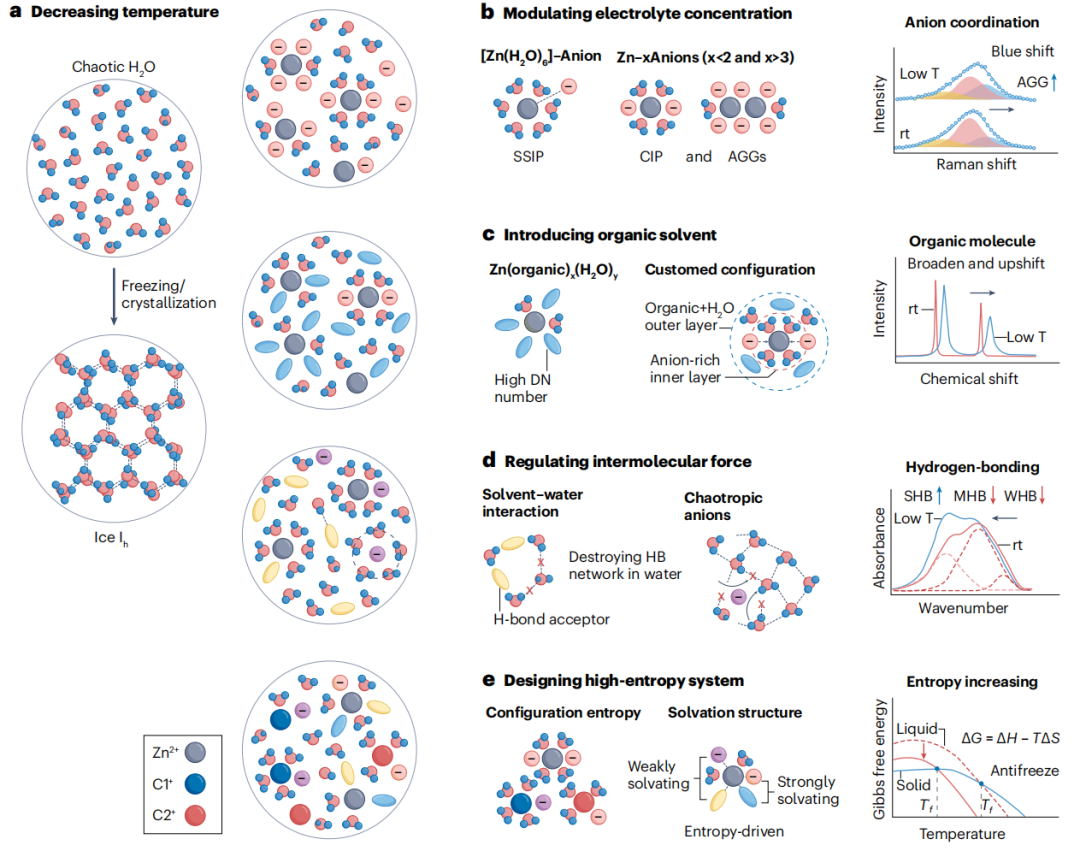
图3 低温策略对水溶液电解质体相和局部溶剂化构型的影响及表现
由于存在大量氢键,水在零度以下的条件下很容易转化为冰(图3a)。扩大水溶液温度范围的一种有效方法是破坏水中的氢键网络以抑制成核,这可以通过下面讨论的策略来实现。例如,调节锌盐浓度。在水溶液中,锌离子与相邻的偶极水分子之间的强静电相互作用形成典型的Zn(H2O)62+水合溶剂化鞘层。锌离子的水合作用阻碍了水的O原子与其他水分子形成氢键。对于阳离子-阴离子相互作用,存在三种不同的聚集状态(图3b)。
在稀电解质中,大多数配合物以溶剂分离离子对的形式存在,有少量的接触离子对。随着浓度的增加,阴离子参与Zn2+的溶剂化壳层,生成Znm(H2O)n簇。在浓电解质中,聚集态占主导地位,其中溶剂化鞘主要由阴离子和少量水分子占据。原则上,减少自由水的数量会增强离子与水的相互作用,从而破坏更多的氢键。因此,盐浓缩可以降低含水电解质的冰点。然而,增加锌盐的浓度会导致更高的粘度,这不利于传质。此外,温度相关的拉曼光谱表明,阴离子-阳离子相互作用随着温度的降低而增加,导致电解质在低温下溶解度降低和盐析出,这限制了浓锌电解质的液相温度范围——物质完全液态的温度范围。
此外,引入有机溶剂也可破坏水中的氢键网络。考虑到极性有机溶剂可以很容易地参与阳离子的配位和溶剂化,并促进固体-电解质界面的产生,高浓度溶剂的引入有助于抑制寄生反应和稳定金属负极。特别地,溶剂添加剂能够与阳离子或阴离子配位以克服盐的晶格能。Gutmann提出的受体和给体数是衡量溶剂接受电子和给电子性质所对应的路易斯酸碱强度的指标。高给体数的分子可以驻留在Zn2+溶剂化鞘层内(图3c)。水含量的大幅降低会极大地破坏原有的氢键网络,这意味着有机溶剂的引入可以用来调整水性电解质的冰点。然而,加入过量的有机溶剂不可避免地会降低离子电导率,增加Zn2+的扩散能垒,并增大脱溶剂能。
在设计低温RZB的水系电解质时,确定盐阴离子、添加剂溶剂和水分子之间的相互作用是至关重要的。某些溶剂作为氢键受体来调节氢键结构(图3d)。选定的分子通常在电负性很强的N、O和F原子上具有孤对电子,孤对电子的存在破坏了氢键网络,从而使调节水溶液的冰点成为可能。由于H2O的受体数较高(54.8,而二甲亚砜的受体数为19.3),因此H2O与破坏结构的阴离子(如ClO4-)之间的相互作用很强,阻碍了水氢键的形成。
设计高熵体系也可破坏水中的氢键网络。高熵电解质(HEEs)通常被定义为含有多种离子和分子物质的电解质系统,整合了不同的溶剂化排列和组合,以达到高度的无序性和复杂性。锌盐的溶解度和水溶液的液相温度取决于体系中组分的吉布斯自由能(ΔG)的变化(图3e)。在热力学上,溶质的溶解度是由一定温度下溶解度的焓(ΔH)和熵(ΔS)变化之间的竞争决定的。因此,引入多种组分来增加ΔS是一种可行的策略,可以促进均匀液体溶液的形成,同时在低温下保持高离子电导率。温度对ΔS的影响在形成均相溶液时更为突出。
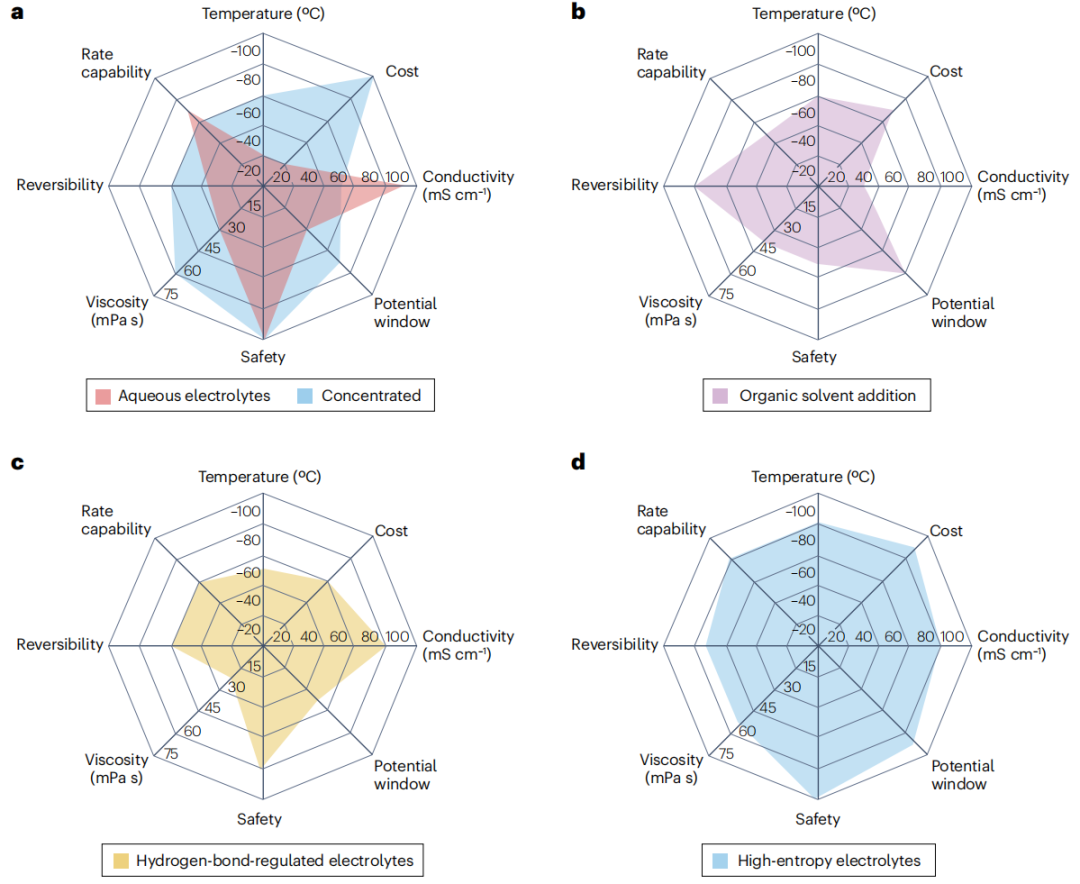
图4 低温水溶液电解质不同设计策略的关键参数多角度比较
目前已经提出了各种策略来解决与低温下RZBs水溶液电解质相关的问题。从多个角度来看,包括基本属性和重要性能指标在内的流行策略如图4所示。具体来说,电解质中高浓度的盐扩大了电化学稳定性窗口并扩大了工作温度范围。然而,浓缩的电解质也会产生问题,比如成本更高、粘度升高和离子电导率降低。
通过引入有机添加剂,“标准”浓度的水溶液电解质提高了锌电镀和剥离的可逆性。低熔点、高极性的有机溶剂可以与Zn2+配合形成坚固的固体-电解质界面,抑制寄生反应,稳定RZBs。然而,有机溶剂添加剂不利于离子电导率、Zn2+的脱溶和倍率性能;此外,使用易燃和挥发性有机物会带来显著的安全风险。添加阴离子和氢键受体分子可以调节氢键相互作用,但通常对整体性能没有显著影响。
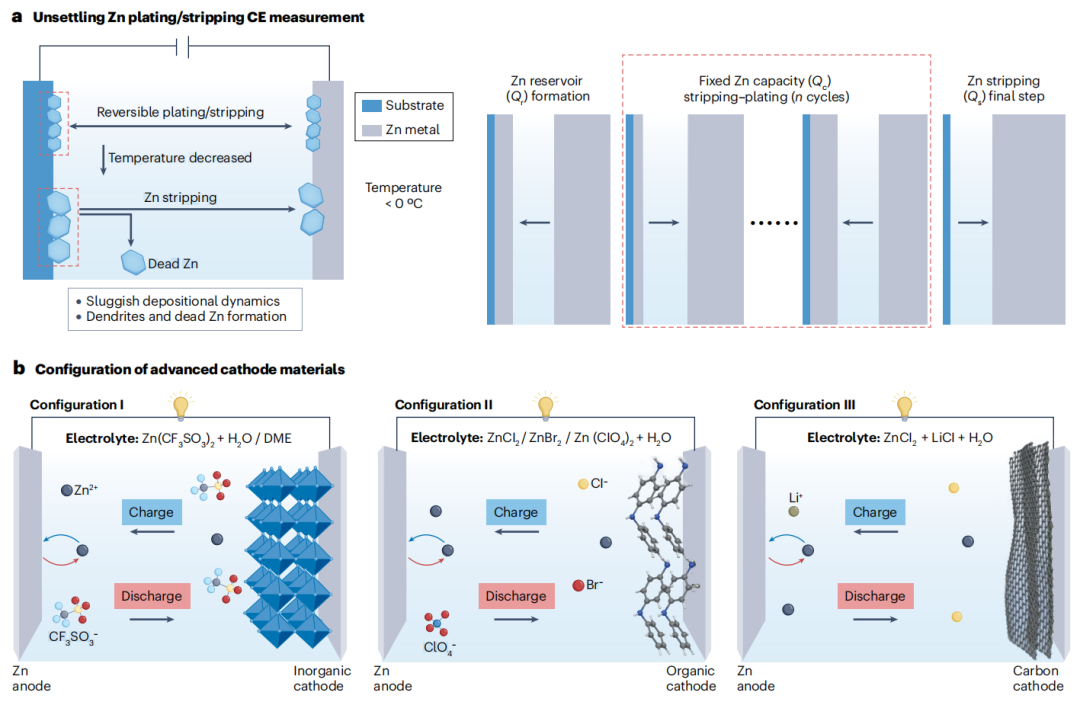
图5 电解质与电极材料的低温相容性
金属锌在低温下的电镀和剥离可逆性较差(图5a)。电解质-电极界面中Zn2+的高水化和扩散能垒严重阻碍了Zn2+的传导、脱溶剂和随后的电荷转移,降低了Zn负极的电镀和剥离动力学,增加了电极过电位。此外,Zn2+离子在低温下的缓慢动力学导致了随机成核,这进一步导致了具有各向异性六方密排晶体结构的金属Zn沉积。随着温度的降低,缓慢的生长逐渐减小了沉积锌的尺寸,并产生了不希望的不可逆性。由于水溶液在室温下的高导电性,随着电镀时间的延长,电极表面的Zn2+浓度不会导致锌离子耗尽层的形成。低温也会影响正极的热力学稳定性和本征动力学。不同正极材料的RZB有三种典型构型(图5b)。无机材料如锰、钒和钼的氧化物和硫化物对温度敏感。在较低温度下,Zn2+在正极主体通道中的嵌入缓慢,导致结构稳定性、容量和CE下降,极化增加。为了提高性能,在电解质中引入低极性的1,2-二甲氧基乙烷添加剂,增强了阴离子和阳离子的配位,而不参与Zn2+的一次溶剂化鞘,从而降低了脱溶剂能。此外,1,2-二甲氧基乙烷的加入破坏了氢键网络,从而改善了电池的低温性能。
与无机阴极相比,四氯苯醌和聚苯胺等有机化合物进行转化氧化还原反应,对温度变化的适应能力更好。电荷存储主要通过Zn离子与官能团的共价键结合进行,因此对载流子尺寸的依赖较小。有趣的是,含有ZnCl2和Zn(ClO4)2电解质的聚苯胺||锌电池(图5b,结构II)在-70℃下提供84.9 mAh g-1的容量,在-80℃下超过1200次循环仍保持~85%的容量。其他无金属正极材料如O2、S、Cl2和I2具有更高的容量,在高能量密度RABs的发展背景下值得更多的关注。在评估锌空气电池的电解质时,HEEs与单原子和单团簇催化剂的结合表现出较高的催化活性,可能为补偿低温下性能下降提供了机会。沿着这条线,结合Li2ZnCl4·9H2O电解质和负载Pt的多孔碳催化剂的锌空气电池(图5b,构型III)在0.4 mA cm-2电流密度和-60至+80℃温度下稳定循环800小时。
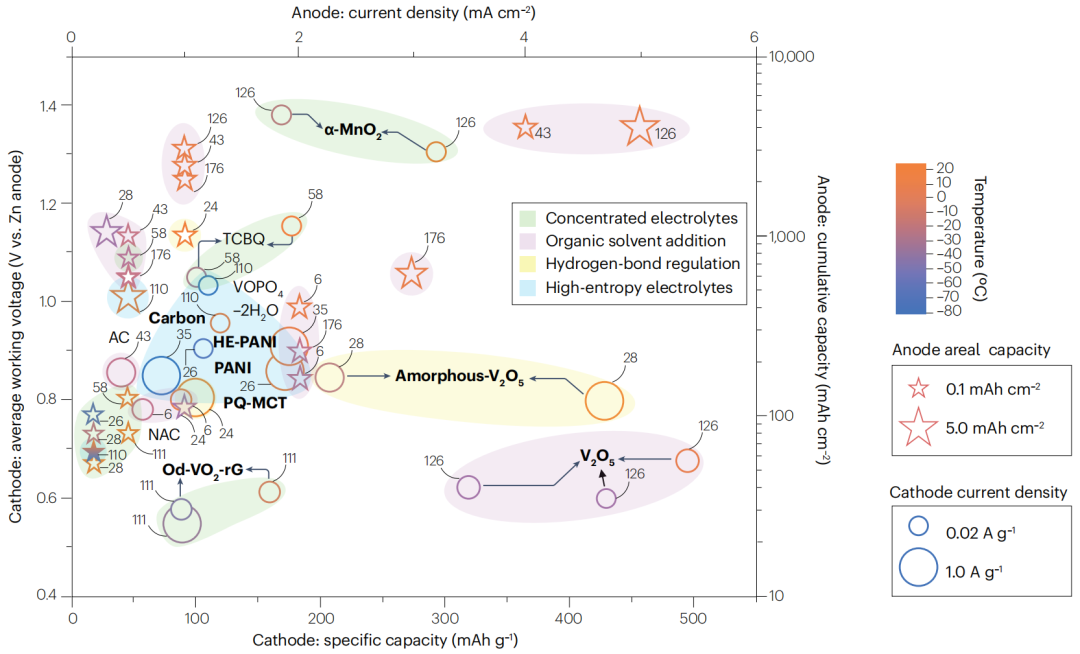
图6 不同电解质策略对不同正极和锌负极的低温性能评价
正极材料的性能取决于从高倍率(1 A g-1)到低倍率(0.02 A g-1)的电解质配方策略,而锌负极则在不同的电流密度(~0.2-5 mA cm-2)和面容量(~0.1-5 mAh cm-2)下进行测试。大多数Zn||Zn对称电池在低电流密度(<1 mA cm-2)下表现出良好的长期可循环性,在温度低于0℃时的面容量高达0.5 mAh cm-2。然而,这些值低于商用锂离子电池(3 mA cm-2和>3 mAh cm-2)。
由于在0℃下Zn2+插入能垒的显著增加,水性电解质的优势不能扩展到大多数无机正极材料的高倍率循环。有机正极,如聚苯胺和四氯苯醌,在-60、-70和-80℃的温度下表现出可观的容量保留率和稳定的电压平台。有机和无机正极材料的温度依赖性性能差异需要进一步的全面研究。

图7 锌电池低温电解质的关键表征与预测技术综述
研究锌盐电解质的固有性质对于开发先进的耐寒水性锌电解质至关重要(图7)。目前对低温水性电解质的研究主要集中在增加盐浓度和引入有机助溶剂来破坏氢键网络。通过调节水分子间的氢键相互作用来改善RZBs的低温性能和工作范围还没有得到很好的研究。
设计HEE结构来加速低温动力学也很有希望,但仍处于起步阶段。需要通过光谱技术(如拉曼光谱、傅立叶变换红外光谱、核磁共振光谱、质量光谱、X射线光电子或吸收光谱及其组合)来更好地理解电解质化学,以揭示锌盐对水-氢键网络、溶剂化构型、离子-分子相互作用、电解质能量学和电极界面的多重影响。
低温会导致电解质盐的析出,而二价锌离子的高解离能垒和小半径限制了锌盐在低温条件下的溶解度。Zn2+的溶剂化结构影响Zn离子(簇)的迁移和扩散、溶剂化和脱溶能垒以及随后的锌沉积和(脱)插层行为。锌盐在水溶液中的溶解和溶剂化对系统的能量学和电池性能有着深远的影响。利用单电荷多原子阴离子锌盐的易解离特性,可以在较宽的温度范围内提高电解质中的离子迁移率,并可以调节Zn2+的溶剂化结构,从而诱导有效的固体-电解质界面相来稳定锌负极。
此外,锌盐的水合物形式虽然没有讨论,但可能在很大程度上决定了加工成本和溶解度,因此在电解质制造中应该考虑到。此外,用于破坏水中氢键的向乱阴离子大大降低了水电解质的冰点,同时提高了电导率。因此,需要更多新颖的电解液配方来实现均匀的镀和剥离,以及锌负极的高容量输出。水溶液电解质和正极之间的相容性是另一个尚未完全了解的性能决定因素。低温下有机材料中质子的插入和提取可以克服无机正极随着温度变化而面临的动态滞后和结构不稳定问题。此外,单原子和单团簇催化剂的针对性设计有望拓宽锌空气电池的应用温度。
文章链接:https://www.nature.com/articles/s41570-024-00670-7
 先进能源材料化学教育部重点实验室(南开大学)
Key Laboratory of Advanced Energy Materials Chemistry, Ministry of Education (Nankai University)
先进能源材料化学教育部重点实验室(南开大学)
Key Laboratory of Advanced Energy Materials Chemistry, Ministry of Education (Nankai University)
